PGD Diagnosi Genetica Preimpianto
Cosa è la Diagnosi Genetica Preimpianto (PGD/PGS)?
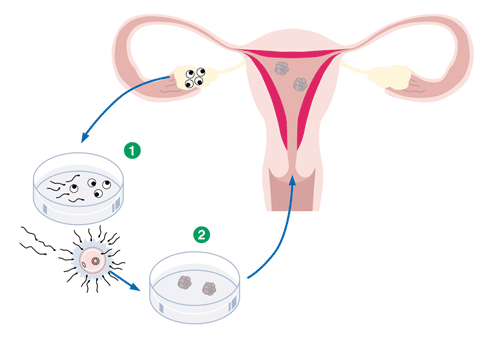
La diagnosi genetica preimpianto rappresenta un’innovativa metodologia che permette di identificare tramite sofisticate tecniche di biologia molecolare la presenza di malattie genetiche ereditarie e/o anomalie cromosomiche in embrioni ottenuti in vitro tramite ciclo di PMA.
Strategie per la diagnosi preimpianto
Screening Genetico Preimpianto (PGS)
Tale diagnostica permette di analizzare il corredo cromosomico dell’embrione prima del transfer, consentendo di identificarne eventuali anomalie numeriche (aneuploidie). E’ particolarmente consigliata nei casi di età materna avanzata, abortività ricorrente, ripetuti fallimenti di impianto e scarsa qualità del liquido seminale.
Diagnosi Genetica Preimpianto (PGD)
La PGD trova applicazione nello studio di patologie monogeniche, autosomiche dominanti, recessive ed associate al cromosoma X (X-linked). Risulta particolarmente consigliata nel caso in cui uno o entrambi i partner fossero portatori sani o affetti da una malattia genetica causata dal deficit o mutazione di un singolo e specifico gene, o da traslocazioni reciproche e robertsoniane.
Ad oggi esistono protocolli diagnostici per oltre 120 malattie monogeniche, autosomiche dominanti, recessive o legate al cromosoma X. Patologie genetiche molto comuni nella popolazione italiana, in cui la PGD oggi trova una valida funzione comprendono: Beta-Talassemia, Anemia Falciforme, Emofilia A e B, Distrofia Muscolare di Duchenne-Becker, Distrofia Miotonica, Fibrosi Cistica, Atrofia Muscolare Spinale (SMA) e X-Fragile.
Diagnosi nei differenti stadi di sviluppo
L’analisi genetica può essere effettuata a partire dall’ovocita fino allo stadio di blastocisti. In ogni stadio si possono presentare delle limitazioni legate alla fisiologia dello sviluppo e seppure si raggiunga una elevata sensibilità della diagnosi genetica, l’accuratezza non supera il 90-95%. A tal proposito è d’obbligo affermare che in caso di gravidanza ottenuta a seguito di tecniche di diagnosi preimpianto, è sempre raccomandato effettuare una diagnosi prenatale invasiva (villocentesi o amniocentesi) per verificare la correttezza della procedura ed aumentare l’accuratezza della diagnosi.
Analisi dei globuli polari
L’analisi dei globuli polari non consente di analizzare anomalie di origine paterna, in quanto l’unico contributo analizzato proviene dall’ovocita. Inoltre subito dopo la fecondazione, il termine della meiosi II può portare a ulteriori difetti genetici non visibili con l’analisi del I° globulo polare, in aggiunta poi ad errori post-zigotici. Tale analisi risulta quindi conveniente e consigliabile solo in casi in cui per motivi religiosi, etici o per scelta della coppia non è possibile effettuare la biopsia di embrioni.
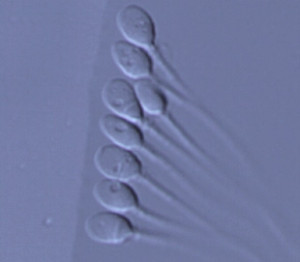
Analisi del blastomero
Questa modalità di prelievo e di analisi rappresenta la procedura più diffusa e viene effettuata al terzo giorno (D3) di coltura embrionale. Il risultato dell’analisi può essere ottenuto entro 24h per cui in caso di assenza di anomalie genetiche, il transfer si può effettuare in quinta giornata (D5) allo stadio di blastocisti. Il limite è rappresentato dal fatto che l’embrione risente del mosaicismo, ossia di un differente stato genetico che varia da blastomero a blastomero, comportando l’esclusione di embrioni in cui difetti genetici erano presenti solo nel blastomero analizzato. Inoltre le aneuploidie potrebbero essere corrette durante l’evoluzione da embrione a blastocisti. Per questi motivi la diagnosi sull’embrione potrebbe risultare consigliabile e particolarmente efficace per lo studio di malattie geniche e cromosomiche note (malattie rare e traslocazioni bilanciate), mentre per l’analisi di aneupoidie (PGS) è consigliabile effettuare la diagnosi su blastocisti.
Analisi con biopsia da blastocisti
L’analisi del materiale trofectodermico permette di studiare e valutare problemi genetici in più cellule, allievando il problema del mosaicismo. E’ la tecnica più recente e nel caso in cui i risultati non siano disponibili entro 24h c’è la possibilità di congelare le blastocisti, che verranno poi trasferite in un seguente ciclo senza la necessità di stimolazione.